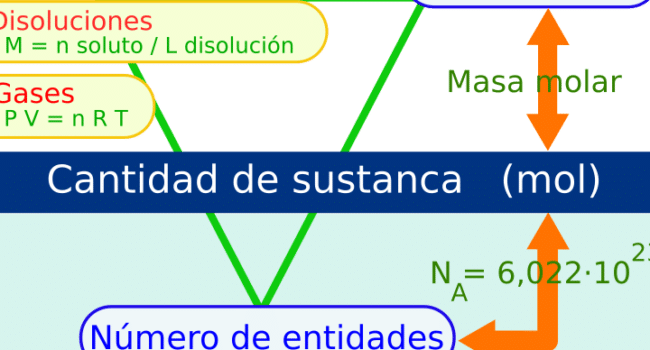
Molalidad: Definición, Fórmula de Concentración y Unidades
- La molalidad, medida crucial en química concentrada en moles de soluto por kilogramo de solvente, destaca por su constancia frente a cambios de presión y temperatura, diferencia fundamental con la molaridad.
- Esta guía detalla su definición, fórmula de cálculo utilizando masa de solvente y moles de soluto, y la importancia de su precisión para aplicaciones prácticas y teóricas.
- Abarca desde la comparación con otras unidades -mostrando su singularidad- hasta su aplicación en cálculos químicos y su papel en investigaciones, diferenciándola claramente de la molaridad y facilitando su medición con técnicas y equipos específicos de laboratorio.
La química, esa ciencia fascinante que desentraña los misterios de la materia. Dentro de su amplio espectro, hay conceptos cruciales que todo aprendiz o profesional debe dominar. Uno de ellos, la molalidad.
Este artículo te guiará exhaustivamente a través de las sinuosidades de la molalidad. Desde su definición y relevancia, hasta su impacto en el mundo de la química. Prepárate para una exploración detallada sobre este esencial indicador de concentración.
- Molalidad: concepto y relevancia
- Fórmula para calcular la molalidad
- Unidades de medida en molalidad
- Aplicaciones de la molalidad
- Comparación: Molalidad vs Molaridad
- Herramientas para la medición de molalidad
- Video Relacionado sobre Molalidad
-
FAQ Acerca de Molalidad
- ¿Qué diferencia a la molalidad de la molaridad?
- ¿Cómo calcular la molalidad a partir de un ejemplo?
- ¿Por qué es importante la independencia de la molalidad frente a la temperatura y la presión?
- ¿Se pueden medir todas las soluciones mediante molalidad?
- ¿Cómo afecta la precisión en el cálculo de molalidad a los resultados experimentales?
- ¿Es posible convertir valores de molaridad a molalidad?
Molalidad: concepto y relevancia
Definición clara de molalidad
¿Alguna vez te has preguntado cómo los científicos logran medir con precisión la concentración de una solución? Ahí es donde entra en juego la molalidad, un término que tal vez hayas escuchado pero cuyo significado puede que se te escape. Simplificando, la molalidad es la medida de la concentración de una solución expresada como la cantidad de moles de soluto disueltos por kilogramo de solvente.
Esta definición, aunque sencilla, tiene implicaciones profundas. Al utilizar el kilogramo de solvente como referencia, la molalidad se convierte en una unidad de concentración especialmente útil en experimentos donde la temperatura y la presión juegan un rol fundamental.
Importancia en el ámbito químico
La relevancia de la molalidad trasciende los límites de un laboratorio. Cada avance científico, cada medicamento desarrollado, cada proceso industrial mejorado, encuentra en la molalidad una herramienta indispensable. Su importancia se destaca en la precisión que otorga a los cálculos químicos, en especial en reacciones que involucran cambios de temperatura y presión.
Fórmula para calcular la molalidad
Elementos necesarios para su cálculo
Para calcular la molalidad, necesitas conocer dos componentes clave: la cantidad de soluto (en moles) y la masa del solvente (en kilogramos). Estos elementos son la base de la fórmula:
Molalidad = Moles de soluto / Masa de solvente (kg)
Es una ecuación sencilla, pero su aplicación es vasta y precisa.
Ejemplos prácticos de cálculo
A veces, lo abstracto se entiende mejor con ejemplos concretos. Imagina que tienes 2 moles de glucosa disueltos en 1 kilogramo de agua. La molalidad de esta solución sería de 2 mol/kg. Simple, ¿verdad? Pero, ¿qué pasa si aumentamos la complejidad un poco? Consideremos una solución con 0.5 moles de sal disueltos en 0.25 kilogramos de agua. Aquí, la molalidad sería de 2 mol/kg de nuevo. Aunque los números cambian, la fórmula nos permite mantener la claridad en nuestros cálculos.
Unidades de medida en molalidad
Diferencia con otras unidades
A primera vista podría parecer que molalidad y molaridad son intercambiables. Sin embargo, la diferencia es fundamental. Mientras la molaridad se centra en los litros de solución, la molalidad se basa en los kilogramos de solvente. Esta distinción no es menor, pues hace de la molalidad una medida más estable ante cambios de temperatura y presión.
Conversión entre unidades
Entender las diferencias es esencial, pero ¿cómo convertimos entre estas unidades? La respuesta depende de la densidad de la solución y las condiciones específicas bajo las cuales se realiza la medición. No hay una fórmula única de conversión aplicable a todos los casos debido a las variables involucradas, haciendo esta tarea un reto interesante para los químicos.
Aplicaciones de la molalidad
Uso en cálculos químicos
Los cálculos de molalidad son fundamentales en la crioscopía y ebulloscopía, técnicas que miden las variaciones del punto de congelación y ebullición de las soluciones. Estas aplicaciones son cruciales en la investigación científica y el desarrollo de nuevos compuestos.
Importancia en investigaciones
En el vasto mundo de la investigación, la molalidad brinda una herramienta precisa para explorar las propiedades físicas de las soluciones. Su exactitud permite a los investigadores avanzar en sus estudios con confianza, sabiendo que sus cálculos de concentración son precisos y confiables.
Comparación: Molalidad vs Molaridad
Definiciones y diferencias clave
Ya mencionamos la diferencia fundamental entre molalidad y molaridad. Pero vale la pena reiterarlo: la molalidad es invariable, una constante frente a temperaturas y presiones cambiantes, a diferencia de la molaridad. Esta característica la hace invaluable en ciertas áreas de la química.
Aplicaciones específicas de cada una
Mientras la molalidad brilla en contextos donde los cambios de temperatura y presión son una constante, la molaridad tiene su momento bajo condiciones más estables. Ambas medidas tienen sus arenas, y conocer cuándo utilizar cada una es signo de maestría en la química.
Herramientas para la medición de molalidad
Equipos de laboratorio esenciales
Medir la molalidad requiere de equipamiento básico de laboratorio: balanzas analíticas para pesar el solvente, pipetas para medir con exactitud el soluto, y un conocimiento profundo de la química.
Técnicas de medición precisas
Además del equipo, las técnicas juegan un rol crucial. La precisión y la meticulosidad en el manejo de las sustancias son esenciales para obtener resultados confiables. Los químicos se entrenan arduamente para dominar estas técnicas, asegurando la exactitud de sus mediciones.
La molalidad no es solo un término más en el vasto campo de la química. Es una herramienta precisa, una llave que abre puertas a la comprensión más profunda de las soluciones. Ya sea a través de la diferenciación clave con la molaridad, sus aplicaciones en investigación, o las técnicas y equipos para su medición, la molalidad se posiciona como un pilar de la ciencia. Su dominio es esencial para todo aquel involucrado en el universo químico, iluminando el camino hacia un mayor entendimiento y avance.
Video Relacionado sobre Molalidad
FAQ Acerca de Molalidad
¿Qué diferencia a la molalidad de la molaridad?
La principal diferencia entre molalidad y molaridad radica en cómo se miden estos términos en el contexto de las soluciones químicas. Mientras que la molalidad se refiere a la cantidad de moles de soluto por kilogramo de solvente, haciendo que sea una medida independiente de la temperatura y la presión, la molaridad se define como la cantidad de moles de soluto por litro de solución. Esto último significa que la molaridad puede variar con los cambios de temperatura y presión debido a la expansión o contracción del volumen de la solución. En consecuencia, para cálculos que requieren alta precisión, especialmente en condiciones variables de temperatura y presión, la molalidad es más fiable que la molaridad.
¿Cómo calcular la molalidad a partir de un ejemplo?
Para calcular la molalidad, se necesita conocer la cantidad exacta de soluto (en moles) y el peso del solvente (en kilogramos). Por ejemplo, suponiendo que se tiene una solución que contiene 2 moles de sacarosa disueltos en 1 kilogramo de agua; la molalidad de esta solución se calcularía simplemente dividiendo los moles de sacarosa (2 moles) por los kilogramos de agua (1 kg), resultando en una molalidad de 2 mol/kg. Este proceso subraya la importancia de una medición precisa de la masa del solvente y la cantidad del soluto para determinar con precisión la concentración molal de una solución.
¿Por qué es importante la independencia de la molalidad frente a la temperatura y la presión?
La independencia de la molalidad frente a cambios en la temperatura y la presión la convierte en una herramienta extremadamente útil en la química analítica y en procesos industriales donde dichas condiciones pueden variar sustancialmente. Esto es particularmente importante para reacciones químicas donde la precisión en la concentración de los reactivos determina la eficacia y rendimiento del proceso. Al ser invariable ante estas variantes, la molalidad asegura una lectura constante de la concentración, ofreciendo resultados más consistentes y predecibles para experimentos y aplicaciones industriales.
¿Se pueden medir todas las soluciones mediante molalidad?
Aunque la molalidad es un método muy efectivo para determinar la concentración de muchas soluciones, puede ser menos práctico en ciertos casos. Esto es especialmente cierto para soluciones de solutos sólidos en solventes sólidos o para ciertos líquidos muy viscotos, donde medir la masa del solvente puede ser complicado o impreciso. Además, para soluciones muy diluidas, otros métodos de concentración, como la molaridad o la fracción molar, pueden ser más convenientes debido a la facilidad de medición del volumen en lugar de la masa.
¿Cómo afecta la precisión en el cálculo de molalidad a los resultados experimentales?
La precisión en el cálculo de la molalidad es crucial para asegurar la fiabilidad de los resultados experimentales en química. Una medición incorrecta de la masa del solvente o del soluto podría llevar a errores en la determinación de la concentración, lo que a su vez afectaría el comportamiento de la solución en la reacción y podría conducir a conclusiones erróneas sobre la dinámica química involucrada. Por ello, es vital emplear instrumentos precisos, como balanzas analíticas, y seguir protocolos estrictos de medición para garantizar la exactitud de estos cálculos.
¿Es posible convertir valores de molaridad a molalidad?
Sí, es posible convertir valores de molaridad a molalidad, aunque el proceso requiere información adicional sobre la densidad de la solución y el peso molecular del soluto. Dado que la molaridad se basa en el volumen de la solución y la molalidad en la masa del solvente, la conversión entre estas medidas de concentración implica el uso de la densidad para pasar de volumen a masa. Este proceso, aunque matemáticamente directo, requiere mediciones precisas y el conocimiento de las propiedades específicas de la solución, evidenciando una vez más la complejidad y la necesidad de precisión en la química analítica.
Si quieres conocer otros artículos parecidos a Molalidad: Definición, Fórmula de Concentración y Unidades puedes visitar la categoría CIENCIAS.
Deja una respuesta

También te puede interesar: