Cómo definimos y qué utilidad tiene la molaridad en química
- La molaridad, una medida crucial en la química, refleja los moles de soluto por litro en una disolución.
- Se calcula dividiendo moles de soluto por volumen en litros, expresándose mayormente en mol/l (M).
- Se distingue de la molalidad por depender de volumen, temperatura y presión.
- Es fundamental para convertir volúmenes de soluciones en masas o moles de solutos y viceversa.
- Su aplicación es variada, desde ajustes por temperatura hasta su uso en fórmulas químicas y laboratorios, subrayando la importancia de solventes y solutos en soluciones homogéneas.
- La atmósfera terrestre ejemplifica perfectamente una solución, con el nitrógeno como solvente principal.
En el vasto universo de la química, la molaridad emerge como una estrella guía que orienta a científicos y estudiantes en el análisis y comprensión de las soluciones químicas. Este concepto, tan esencial como complejo, se erige como una herramienta fundamental en el laboratorio y en la teoría.
La molaridad no es solo una cifra más en el extenso inventario de la química; es el lenguaje universal que permite a los químicos de todo el mundo comunicarse y transmutar sus ideas en experimentos precisos y replicables. Acompáñanos en este fascinante viaje a través de la definición, importancia y aplicaciones prácticas de la molaridad en química.
- Definición y cálculo de la molaridad
- Importancia de la molaridad en química
- Relación entre molaridad, presión y temperatura
- Conceptos clave en la molaridad
- Conversiones utilizando la molaridad
- Ejemplos prácticos de cálculo de molaridad
- Conclusión
- Video Relacionado sobre Molaridad
- FAQ Acerca de Molaridad
Definición y cálculo de la molaridad
Expresión común y simbología
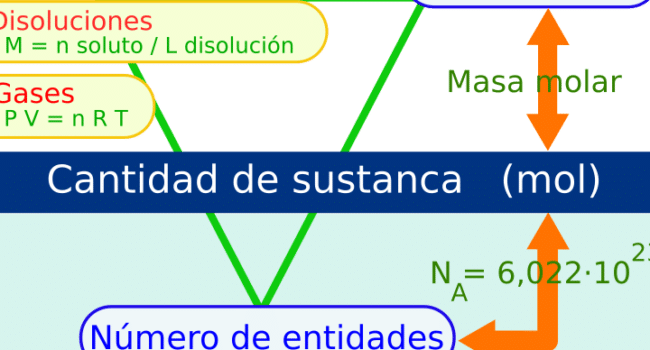
La molaridad se define como la cantidad de moles de soluto presentes en un litro de solución. Esta se simboliza con la letra "M", expresándose comúnmente en unidades de mol/L. Un mol, en este contexto, es una unidad que representa 6.022 x 1023 partículas de una determinada sustancia, cifra conocida como número de Avogadro.
Diferencia entre molaridad y molalidad
A menudo, la molaridad se confunde con la molalidad; sin embargo, son conceptos distintos. La molalidad mide los moles de soluto por kilogramo de solvente, independiente del volumen de la solución. Esta diferencia es crucial, pues la molalidad no varía con cambios en la temperatura, a diferencia de la molaridad.
Importancia de la molaridad en química
Aplicaciones prácticas en laboratorio
La molaridad es indispensable en el laboratorio para la preparación de soluciones con concentraciones específicas. Facilita la estandarización de reacciones, permitiendo a los científicos replicar experimentos en cualquier lugar del mundo con precisión.
Uso en fórmulas químicas
La molaridad aparece en numerosas ecuaciones químicas y cálculos, como la ley de los gases ideales y la constante de equilibrio. Este uso subraya la centralidad de la molaridad en la química tanto teórica como aplicada.
Relación entre molaridad, presión y temperatura
Factores de corrección por temperatura
Dado que la molaridad depende del volumen, que a su vez es afectado por la temperatura y presión, es esencial aplicar correcciones para mantener la precisión. Los factores de corrección permiten ajustar las concentraciones en función de estas variaciones ambientales.
Conceptos clave en la molaridad
El rol del soluto y solvente
En el cálculo de la molaridad, el soluto y el solvente juegan roles definidos; el soluto es la sustancia que se disuelve, mientras que el solvente es el medio en el que el soluto se disuelve. La proporción entre ellos determina la concentración de la solución.
Disoluciones y mezclas homogéneas
Las soluciones son mezclas homogéneas en las que los componentes se mezclan tan íntimamente que no se pueden distinguir a simple vista. La molaridad ayuda a describir estas mezclas en términos de su composición química.
Conversiones utilizando la molaridad
De moles a volumen de solución
La molaridad facilita la conversión entre la cantidad de moles de soluto y el volumen de una solución. Este tipo de cálculos son esenciales en preparaciones laboratoriales.
De volumen a masas de soluto
Con la molaridad, también es posible convertir el volumen de una solución a la masa del soluto disuelto, empleando la masa molar del soluto. Estas conversiones son críticas en el diseño y análisis de experimentos químicos.
Ejemplos prácticos de cálculo de molaridad
A lo largo de nuestra exploración de la molaridad, hemos descubierto cómo este concepto es esencial para la comprensión y aplicación de la química. Ahora, visualicemos su uso a través de ejemplos donde calcularemos la molaridad en diferentes escenarios, ilustrando la universalidad y potencia de esta herramienta en el laboratorio químico.
Conclusión
La molaridad es mucho más que un simple número en el mundo de la química; es una llave maestra que abre las puertas a la experimentación precisa, la estandarización de procesos, y la comunicación científica. A través de este extenso recorrido, hemos desglosado su concepto, importancia y aplicabilidad, demostrando que, lejos de ser un mero detalle técnico, la molaridad es un pilar fundamental en la química moderna.
Video Relacionado sobre Molaridad
FAQ Acerca de Molaridad
¿Cómo se define la molaridad?
La molaridad, clave en el estudio de la química, se define como la concentración molar de una solución, representando la cantidad de moles de soluto presentes en un litro de disolución. Esta medida, expresada como moles por litro (mol/L) y simbolizada comúnmente con una "M", proporciona una evaluación precisa de la concentración de una solución. Para calcularla, se divide el número de moles de soluto por el volumen total de la disolución en litros. Esta aproximación nos permite estandarizar las soluciones y facilita comparar directamente las concentraciones de diferentes soluciones.
¿Para qué se utiliza la molaridad en química?
La molaridad es una herramienta indispensable en el laboratorio químico y en la industria, ya que permite a los químicos preparar soluciones con concentraciones precisas necesarias para una amplia gama de aplicaciones. Desde reacciones químicas hasta el análisis de sustancias, la molaridad juega un papel crucial en la estandarización de procedimientos y en la obtención de resultados reproducibles y precisos. Además, facilita el cálculo de reactivos requeridos en una reacción o la determinación de la cantidad de soluto en un determinado volumen de solución. En contextos académicos, la molaridad es fundamental para el entendimiento y la enseñanza de los conceptos relacionados con las soluciones y sus concentraciones.
¿Qué diferencia la molaridad de la molalidad?
La molaridad y la molalidad son dos conceptos similares, pero con diferencias clave en su definición y aplicación. Mientras que la molaridad se refiere a la cantidad de moles de soluto por litro de solución, la molalidad mide los moles de soluto por kilogramo de solvente. Esta diferencia es esencial, ya que la molaridad se ve afectada por cambios en la temperatura y presión, debido a su dependencia del volumen de la solución, mientras que la molalidad, al basarse en la masa del solvente, no sufre alteraciones ante estos cambios ambientales. Este aspecto hace a la molalidad especialmente útil en condiciones que requieren mayor precisión en la medición de concentraciones bajo variaciones de temperatura.
¿Cómo afecta la temperatura a la molaridad?
La temperatura tiene un impacto directo en la molaridad debido a su influencia sobre el volumen de la disolución. Al aumentar la temperatura, es común que el volumen de una solución se expanda, mientras que al disminuir, este se contrae. Como la molaridad se calcula dividiendo la cantidad de moles de soluto entre el volumen de solución en litros, cualquier cambio en el volumen provocado por variaciones de temperatura puede alterar el valor de la concentración molar. Para corregir estos efectos y obtener medidas precisas, los químicos aplican factores de corrección o realizan cálculos a una temperatura de referencia, asegurando así la precisión en la elaboración y análisis de soluciones químicas.
¿Qué es una solución valorada molar?
Una solución valorada molar es aquella cuya concentración molar ha sido precisamente determinada y ajustada para cumplir con criterios de estandarización específicos. Estas soluciones son fundamentales en el ámbito de la química analítica y en procesos industriales, ya que ofrecen una confiabilidad y precisión esenciales para experimentos, análisis químicos y la fabricación de productos. La preparación de estas soluciones implica procedimientos meticulosos para medir y mezclar el soluto y el solvente, asegurando que la concentración final sea exactamente la requerida para el propósito deseado.
Si quieres conocer otros artículos parecidos a Cómo definimos y qué utilidad tiene la molaridad en química puedes visitar la categoría CIENCIAS.
Deja una respuesta

También te puede interesar: